การเสริมสร้างการวิจัยและพัฒนา เป็นหนึ่งในภารกิจหลักของสำนักงานวิทยาศาสตร์และเทคโนโลยีแห่งชาติ (สวทช.) การวิจัยและพัฒนาอย่างมีคุณภาพและเป็นไปตามแนวทางจริยธรรมการวิจัยและกฏหมายที่เกี่ยวข้องจึงเป็นสิ่งที่พึงตระหนัก สวทช. ได้จัดตั้งฝ่ายส่งเสริมจริยธรรมการวิจัย (The Office of Research Integrity, ORI) เพื่อทำหน้าที่ส่งเสริมการวิจัยให้ถูกต้อง สอดคล้องตามหลักจริยธรรมการวิจัยและกฎหมายที่เกี่ยวข้อง อีกทั้งรับผิดชอบในการรับแจ้งเบาะแสและข้อร้องเรียนทางด้านพฤติกรรมมิชอบทางการวิจัย (Research Misconduct) เพื่อนำเรื่องร้องเรียนเข้าสู่กระบวนการสืบสวนและพิจารณาต่อไป
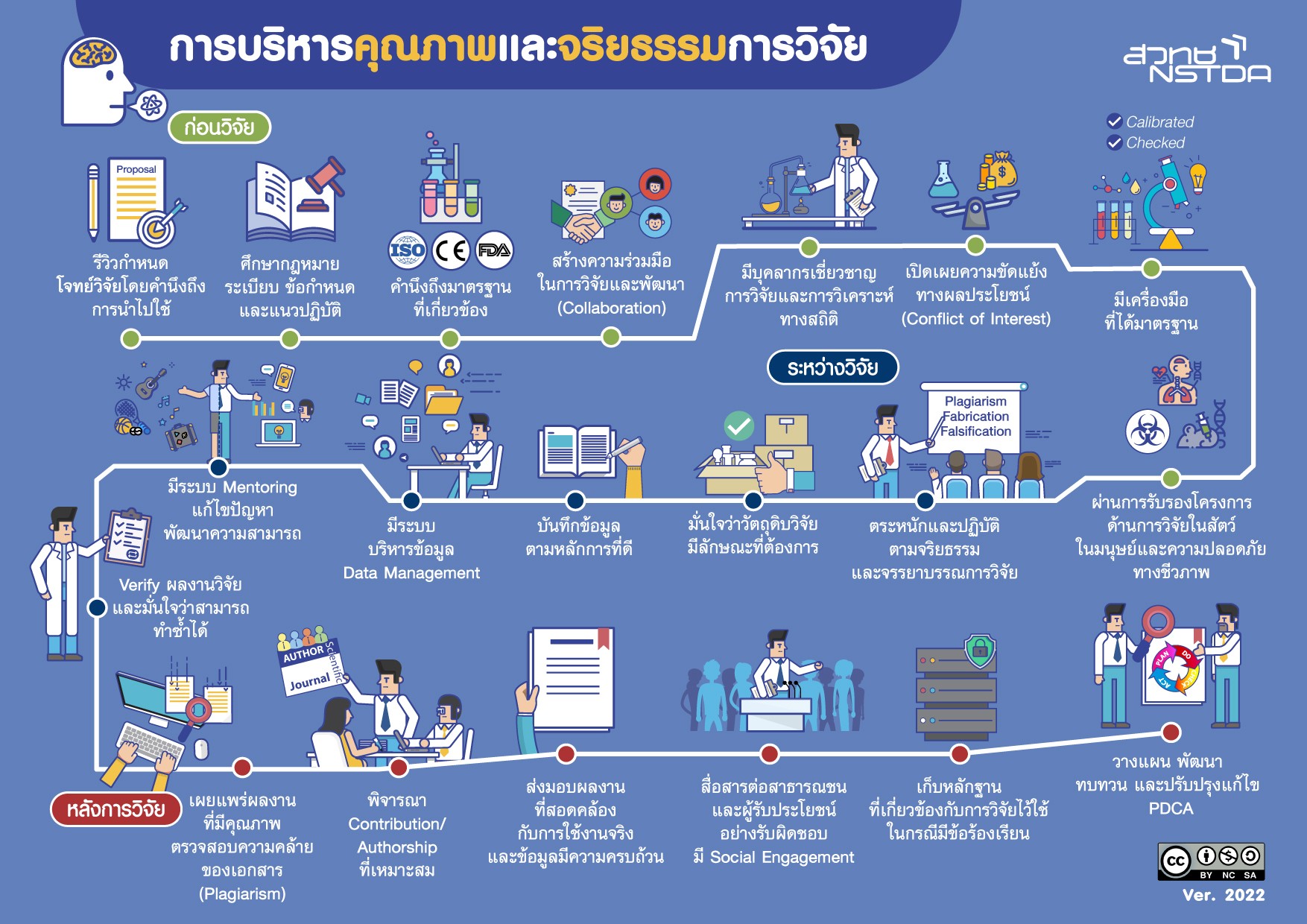
Research integrity หมายถึง ความซื่อสัตย์สุจริตในการวิจัย โดยการปฏิบัติตามกฎระเบียบ ข้อบังคับ แนวทาง มาตรฐานวิชาชีพ และหลักจริยธรรมการวิจัย ซึ่งในทางปฏิบัติ คือ การทำวิจัยในลักษณะที่ทำให้ผู้อื่นมีความไว้วางใจและความเชื่อมั่นในวิธีการทดลองที่ใช้และผลการวิจัยที่เกิดขึ้น โดยมีองค์ประกอบที่สำคัญ ได้แก่
- ความซื่อสัตย์สุจริตและเป็นธรรม ในการนำเสนองานวิจัย การทำวิจัย และการรายงานผลวิจัย
- การแจ้งหรือประกาศการขัดกันของผลประโยชน์ (Conflicts of Interest)
- ความถูกต้องและเป็นธรรม ในการมีส่วนร่วมต่อข้อเสนอโครงการวิจัยและการรายงานผล
- การปกป้องคุ้มครองอาสาสมัครตามหลักจรรยาบรรณการวิจัยในมนุษย์
- การดูแลและปฏิบัติต่อสัตว์อย่างมีมนุษยธรรมตามหลักจรรยาบรรณการใช้สัตว์เพื่องานทางวิทยาศาสตร์
- การมีปฏิสัมพันธ์กันระหว่างกลุ่มวิจัยในเชิงวิชาการ การสื่อสาร และการแบ่งปันข้อมูลหรือทรัพยากร
- ความยึดมั่นต่อการรับผิดชอบร่วมกันระหว่างที่นักวิจัยที่ปรึกษาหรือพี่เลี้ยงและผู้ฝึกปฏิบัติงาน
- ความเชี่ยวชาญและเป็นธรรมในการตรวจทานงานวิจัย
เพื่อเป็นการพัฒนาและส่งเสริมงานวิจัยและผลงานทางวิชาการของ สวทช. ให้มีคุณภาพ มาตรฐาน และเชื่อถือได้สอดคล้องกับหลักจริยธรรมการวิจัยและกฎหมายที่เกี่ยวข้อง และเป็นช่องทางให้แก่ ผู้วิจัย ผู้เข้าร่วมวิจัย และผู้มีส่วนได้ส่วนเสียในการวิจัย สามารถสอบถาม แจ้งข้อกังวล หรือดำเนินการร้องเรียนเกี่ยวกับการประพฤติผิดจริยธรรมการวิจัย โดยต้องเป็นกรณีที่เกี่ยวข้องกับ สวทช. (เช่น ผู้วิจัยเป็นบุคลากรของ สวทช.) และเกี่ยวข้องกับเรื่องใดเรื่องหนึ่งดังต่อไปนี้
1. กรณีที่เป็นพฤติกรรมที่อาจเข้าข่ายการประพฤติมิชอบทางการวิจัย (Research misconduct)
1. Fabrication การสร้างข้อมูลเท็จหรือการปั้นแต่งข้อมูลวิจัย
2. Falsification การปลอมแปลงข้อมูลหรือผลการวิจัย
3. Plagiarism การคัดลอกงานวิจัยของตนเองและผู้อื่น โดยไม่มีการอ้างถึง แหล่งข้อมูลที่ได้มา
4. อื่นๆ
2. กรณีที่เป็นโครงการวิจัยที่อาจมีการดำเนินงานไม่เป็นไปตามมาตรฐานด้านจริยธรรมการวิจัยที่เกี่ยวข้อง เช่น ด้านจรรยาบรรณการใช้สัตว์เพื่องานทางวิทยาศาสตร์ ด้านจริยธรรมการวิจัยในมนุษย์ หรือ ด้านความปลอดภัยทางชีวภาพ เป็นต้น
3. กรณีที่คณะกรรมการด้านมาตรฐานและจริยธรรมการวิจัย มีการใช้อำนาจโดยมิชอบ หรือ ต้องการอุทธรณ์มติของคณะกรรมการฯ หรือ สอบถามและร้องเรียนเกี่ยวกับกระบวนการทบทวนด้านจริยธรรมการวิจัยของคณะกรรมการฯ โดยคณะกรรมการด้านมาตรฐานและจริยธรรมการวิจัย ของ สวทช. ได้แก่ คณะกรรมการพัฒนาส่งเสริมและสนับสนุนจริยธรรมการวิจัยในมนุษย์ (NSTDA-IRB) คณะกรรมการกำกับดูแลการดำเนินการต่อสัตว์เพื่องานทางวิทยาศาสตร์ (NSTDA-IACUC) คณะกรรมการความปลอดภัยทางชีวภาพ (NSTDA-IBC) และคณะกรรมการจริยธรรมปัญญาประดิษฐ์ (NSTDA-AIEC)
ท่านสามารถแจ้งเบาะแสและร้องเรียนด้านมาตรฐานและจริยธรรมการวิจัยที่เกี่ยวข้องกับ สวทช. ผ่านทางช่องทางที่ให้ไว้ด้านล่าง
ทั้งนี้:
1. สวทช. จะรักษาข้อมูลที่ได้รับเป็นความลับ จะไม่มีการเปิดเผยข้อมูลและตัวตนของผู้แจ้งเบาะแสหรือผู้ร้องเรียน และผู้ถูกร้องเรียนต่อสาธารณชน
2. ข้อมูลการแจ้งเบาะแสและข้อร้องเรียนที่ระบุต้องเป็นความจริง
3. ผู้แจ้งเบาะแสหรือผู้ร้องเรียนสามารถเลือกเปิดเผยหรือไม่เปิดเผยข้อมูลส่วนตัว เช่น ระบุชื่อ-สกุล หรือ อีเมลของท่าน อย่างไรก็ตาม การให้ชื่อและอีเมลจะเป็นประโยชน์ในการติดตามผลและการสืบหาข้อเท็จจริง รวมทั้งเพิ่มความน่าเชื่อถือของข้อมูล
4. หากข้อมูลไม่เพียงพอที่จะดำเนินการตรวจสอบและสืบหาข้อเท็จจริงได้ สวทช. จะยุติเรื่อง และเก็บบันทึกเป็นข้อมูลในระบบฐานข้อมูล
5. ฝ่ายพัฒนาคุณภาพและจริยธรรมการวิจัย สวทช. ขอสงวนสิทธิ์รับแจ้งเฉพาะเบาะแสและเรื่องร้องเรียนที่เกี่ยวข้องกับด้านจริยธรรมการวิจัย และ สวทช. เท่านั้น เนื่องจากคณะกรรมการจริยธรรมการวิจัย สวทช. มีอำนาจหน้าที่ในการดูแลเฉพาะประเด็นที่เกี่ยวข้องกับด้านมาตรฐานและจริยธรรมการวิจัยของ สวทช. เท่านั้น
ข้อมูลสำหรับแจ้งเบาะแสและข้อร้องเรียน
1. รายละเอียดเบาะแสหรือข้อร้องเรียนด้านมาตรฐานและจริยธรรมการวิจัยที่เกี่ยวข้องกับ สวทช. (โปรดแนบหลักฐานเพิ่มเติม)*
2. อีเมล
3. ชื่อ-สกุล
หมายเหตุ: ข้อมูลสำหรับแจ้งเบาะแสและข้อร้องเรียน ข้อ 2) อีเมล และ 3) ชื่อ-สกุล ผู้แจ้งเบาะแสสามารถละเว้นไว้หรือใช้อีเมลแฝง/นามแฝงได้ อย่างไรก็ตาม การให้ข้อมูลในการติดต่อกลับ จะเป็นประโยชน์ในการติดตามผลและการสืบหาข้อเท็จจริง รวมทั้งเพิ่มความน่าเชื่อถือของข้อมูล
ท่านสามารถแจ้งเบาะแสหรือข้อร้องเรียนของท่านมาที่อีเมล: ORI2@nstda.or.th
หรือแจ้งเบาะแสผ่านทางระบบออนไลน์ คลิก
ฝ่ายพัฒนาคุณภาพและจริยธรรมการวิจัย
สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ (สวทช.)
Email: QRI@nstda.or.th
โทรศัพท์: 0-2564-7000 ต่อ 71843-44,71834