เปิดความก้าวหน้างานวิจัยนานาชาติ ผนึกกำลังช่วยหยุดยั้งโควิด-19

โรคโควิด-19 เป็นโจทย์ปัญหาใหญ่ที่ท้าทายคนทั้งโลก สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ (สวทช.) ตระหนักในความสำคัญของการใช้ความรู้ด้านวิทยาศาสตร์และเทคโนโลยี เพื่อรับมือโรคระบาดใหญ่เช่นนี้อย่างมีประสิทธิภาพมากที่สุด จึงได้จัดสัมมนาออนไลน์ในหัวข้อ International Webinar on COVID-19 ขึ้น เพื่อแลกเปลี่ยนความรู้และติดตามความก้าวหน้าการพัฒนาเทคโนโลยีสู้โรคโควิด-19 ของนานาชาติ โดยมีผู้เชี่ยวชาญระดับโลกและนักวิจัยจากไบโอเทค สวทช. ร่วมเป็นผู้บรรยาย ภายในงานประชุมวิชาการประจำปี สวทช. ครั้งที่ 17 (17th NSTDA Annual Conference: NAC2022) ที่จัดขึ้นภายใต้แนวคิด “พลิกฟื้นเศรษฐกิจและสังคมไทย ด้วยงานวิจัยและนวัตกรรม BCG” ระหว่างวันที่ 28-30 มีนาคม พ.ศ. 2565 ที่ผ่านมา
เบื้องหลังความสำเร็จวัคซีน mRNA

ดร.พีเตอร์ คุลลิส (Dr. Pieter Cullis) ศาสตราจารย์ด้านชีวเคมีและอณูชีววิทยา (Molecular Biology) จากศูนย์วิทยาศาสตร์ชีวิต (Life Science Centre) เมืองแวนคูเวอร์ ประเทศแคนาดา ผู้เชี่ยวชาญด้านการแพทย์นาโน (Nanomedicine) กล่าวถึงการทำงานวิจัยเกี่ยวกับการพัฒนา LNP (Lipid Nanoparticle) หรืออนุภาคระดับนาโนที่มีไขมันเป็นส่วนประกอบ เพื่อพัฒนาระบบส่งยาจำพวกกรดนิวคลีอิกไปยังอวัยวะเป้าหมายและเข้าสู่เซลล์ชนิดที่จำเพาะ
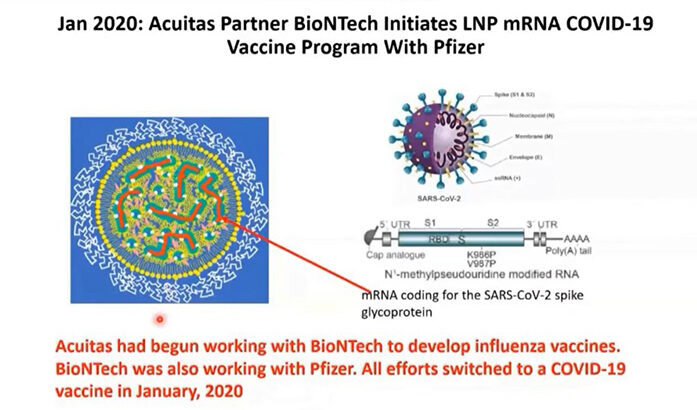
การสร้าง LNP ต้องใช้ไขมันที่มีประจุบวก ทว่าในธรรมชาติมีเพียงไขมันที่มีประจุลบและไขมันที่เป็นกลางเท่านั้น อีกทั้ง LNP แบบประจุบวกส่วนใหญ่ยังมีความเป็นพิษสูงอีกด้วย จึงเป็นความท้าทายอย่างยิ่งที่จะสร้าง LNP แบบประจุบวกที่มีประสิทธิภาพในการนำส่งสารสำคัญแต่มีความเป็นพิษน้อย ซึ่งในที่สุด ดร.คุลลิสก็ทำสำเร็จ โดย LNP ที่สร้างขึ้นสามารถใช้นำส่งส่วนประกอบต่างๆ ของระบบ siRNA ได้ จึงนำมาใช้ในการบำบัดด้วยยีนสำหรับรักษาโรคพันธุกรรมบางอย่าง เช่น โรคอะมีลอยโดซิสชนิดที่เกิดจากความผิดปกติของยีน (Hereditary Amyloid Transthyretin Amyloidosis; hATTR) ซึ่งได้รับการอนุมัติจากองค์การอาหารและยา (FDA) สหรัฐอเมริกา เมื่อวันที่ 10 สิงหาคม พ.ศ. 2561
ต่อมาเมื่อเกิดการระบาดของโรคโควิด-19 จึงมีการประยุกต์ใช้ LNP ที่มี mRNA เป็นส่วนประกอบ เพื่อใช้เป็นวัคซีนสำหรับโรคโควิด-19 โดย ดร.คุลลิสได้ทำวิจัยร่วมกับ ดร.ดรูว์ ไวส์แมน (Dr. Drew Weissman) นักวิทยาศาสตร์การแพทย์ชาวอเมริกัน และ ดร.คาทาลิน คาริโค (Dr. Katalin Kariko) นักชีวเคมีชาวฮังการี ที่ต้องการวิธีนำส่งสารที่มีประสิทธิภาพดี ซึ่งนำไปสู่ความสำเร็จในการพัฒนาวัคซีนโควิด-19 ชนิด mRNA ของบริษัท Pfizer-BioNTech และ Moderna ที่ใช้อย่างแพร่หลายในปัจจุบัน
ทั้งนี้ จากการเป็นผู้บุกเบิกงานวิจัยด้าน LPN เพื่อพัฒนาระบบนำส่งยาของ ดร.คุลลิส และจากความพยายามร่วมกันเป็นเวลานานของ ดร.ไวส์แมนและ ดร.คาริโค ในการนำ mRNA มาใช้ประโยชน์ทางการแพทย์ จนเกิดผลสำเร็จเป็นวัคซีน mRNA ดังกล่าว จึงส่งผลให้ทั้ง 3 ท่าน ได้รับพระราชทานรางวัลสมเด็จเจ้าฟ้ามหิดล ประจำปี พ.ศ. 2564 สาขาการแพทย์ ร่วมกัน
พัฒนาวัคซีนชนิด Protein Subunit สู้เชื้อกลายพันธุ์

ดร.จอร์จ เอฟ. เกา (Dr. George F. Gao) ศาสตราจารย์ด้านวิทยาไวรัสและวิทยาภูมิคุ้มกัน ผู้อำนวยการศูนย์ควบคุมและป้องกันโรคแห่งประเทศจีน (Chinese Center for Disease Control and Prevention) กล่าวว่า เชื้อก่อโรคโควิด-19 สายพันธุ์โอมิครอน มีการเปลี่ยนกรดอะมิโนที่บริเวณโครงสร้างของหนาม (spike) ที่ใช้จับกับตัวรับของเซลล์มากถึง 30 ตำแหน่ง หลายตำแหน่งตรงกับที่พบในไวรัสอื่นก่อนหน้านี้ ซึ่งมีส่วนช่วยให้หลบรอดระบบภูมิคุ้มกันได้ดีขึ้น และพบการเปลี่ยนแปลงของ 3 ตำแหน่งที่ทำให้จับกับตัวรับของสิ่งมีชีวิตได้มากชนิดยิ่งขึ้น
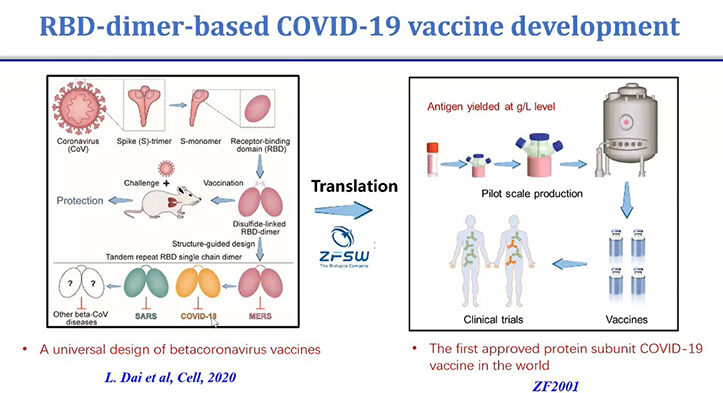
การกลายพันธุ์ของไวรัสกับการรับมือของระบบภูมิคุ้มกันของร่างกาย คล้ายกับ “ทอมกับเจอร์รี่” ที่หนีกันไปและวิ่งไล่กันไปตลอดเวลา ความท้าทายที่เผชิญกันอยู่ตอนนี้คือการลดลงของระดับภูมิคุ้มกันหลังฉีดวัคซีน และความสามารถในการทำให้ติดเชื้ออย่างก้าวกระโดดของเชื้อสายพันธุ์โอมิครอนและสายพันธุ์ย่อย โดยมาตรการที่ใช้รับมือตอนนี้คือการฉีดวัคซีนเข็มกระตุ้นเพิ่มหลังจากฉีดครบ 2 โดสแล้ว และการฉีดวัคซีนชนิดอื่นที่ต่างจากเดิม ซึ่งวัคซีนที่ผลิตเพื่อใช้ต่อสู้กับโคโรนาไวรัสตอนนี้มี 7 แบบ หนึ่งนั้นคือชนิดใช้หน่วยย่อยโปรตีน (Protein Subunit) กระตุ้นภูมิคุ้มกัน ขณะนี้มีวัคซีนชนิด Protein Subunit อยู่ 12 ชนิดที่ใช้กันอยู่ทั่วโลก ชนิดที่ใช้กว้างขวางที่สุดคือ Novavax ซึ่งใช้ใน 32 ประเทศ และมีวัคซีนชนิดที่ใช้ในประเทศเดียวอยู่ 7 ชนิด
ทั้งนี้ ศ.เกามีส่วนร่วมในการสร้างวัคซีนชนิด Protein Subunit (ชื่อ ZF2001) ที่ออกแบบโดยนำ Receptor ต่อโปรตีนหนามของโคโรนาไวรัส 2 โมเลกุลมาเชื่อมต่อกัน เมื่อทดลองในหนูพบว่าทำให้เกิดภูมิคุ้มกันต่อ SARS-CoV-2 ได้ และได้กลายมาเป็นวัคซีนชนิด Protein Subunit ชนิดแรกของโลก ซึ่งต่อมาพบว่าใช้กับเชื้อกลายพันธุ์ได้ด้วย และจากการทดลองในหนูแสดงให้เห็นว่าสามารถใช้เป็นเข็มกระตุ้นได้ดี
นอกจากนี้มียาหลายชนิดที่อยู่ระหว่างการพัฒนา ชนิดแรกคือ Etesevimab ที่เป็นโมโนโคลนัลแอนติบอดี (Monoclonal Antibody) ชนิดฉีดที่ออกฤทธิ์กับตัวรับของโปรตีนหนามของ SARS-CoV-2 ชนิดที่สองคือ Molnupiravir ของบริษัท Merck เป็นยารับประทานซึ่งเป็นเอนไซม์ที่ตัดสาย RNA ของไวรัส จึงช่วยยับยั้งการเพิ่มจำนวนเชื้อไวรัสได้ ชนิดที่สามคือ Paxlovid ของบริษัท Pfizer หรืออีกชื่อหนึ่งคือ Ritonavir เป็นยารับประทานที่ลดอาการป่วยหนักหรือเสียชีวิตได้ถึง 89% โดยออกฤทธิ์ยับยั้งเอนไซม์ Protease ของไวรัส นอกจากนี้ยังมียาสมุนไพรพื้นเมืองของจีนเรียกว่า TCM Herbs ที่ออกฤทธิ์คล้ายกับ Paxlovid ด้วย
“โมโนโคลนัลแอนติบอดี” เสริมทัพวัคซีนหยุดยั้งโควิด-19

นพ.เออร์เนสโต โอวีโด-ออร์ตา (Dr. Ernesto Oviedo-Orta) ผู้เชี่ยวชาญด้านวิทยาศาสตร์คลินิกของบริษัท Novartis Vaccines & Diagnostics Siena ประเทศอิตาลี ปัจจุบันดำรงตำแหน่ง Infectious Disease Lead บริษัท Regeneron Pharmaceuticals, Inc. อธิบายถึงความสามารถของเชื้อไวรัส SARS-CoV-2 ซึ่งเข้าสู่เซลล์ได้ดีที่เยื่อบุผิวของปอดและลำไส้เล็ก รวมไปถึงเยื่อบุหลอดเลือด เมื่อไวรัสเข้าเซลล์ได้จะแบ่งตัวเพิ่มจำนวน โดยช่วงที่แบ่งตัวมากที่สุดคือระยะที่เริ่มมีอาการป่วยน้อยไปจนถึงปานกลาง ขณะที่ตอนยังไม่มีอาการหรือเมื่อป่วยหนักแล้วเชื้อไวรัสจะแบ่งตัวน้อย

อย่างไรก็ตาม มีงานวิจัยที่ชี้ว่าสามารถใช้โมโนโคลนัลแอนติบอดี (mAb) รักษาผู้ป่วยจากโรคโควิด-19 ได้ และเมื่อเปรียบเทียบวัคซีนกับ mAb พบว่ามีส่วนคล้ายกันคือมีความจำเพาะกับเชื้อโรค แต่มีรายละเอียดหลายอย่างที่แตกต่างกัน ประการแรกคือ mAb ใช้ปกป้องร่างกายจากเชื้อไวรัสได้ทันที ส่วนวัคซีนต้องใช้เวลาสร้างภูมิ ประการที่สอง mAb ออกฤทธิ์ระยะสั้นๆ ตรงข้ามกับวัคซีนที่ออกฤทธิ์ยาวนานกว่า ประการที่สาม วัคซีนกระตุ้นให้เกิดภูมิคุ้มกันในร่างกายคล้ายกับการที่ร่างกายตอบสนองกับเชื้อโรคตามธรรมชาติ แต่ mAb ที่ฉีดเข้าไปจะเป็นตัวไปทำลายเชื้อโรคโดยตรง และประการสุดท้ายคือแอนติบอดีที่เกิดขึ้นในกรณีของวัคซีนนั้น เกิดขึ้นภายในร่างกาย แต่กรณีการฉีด mAb เป็นการรับเข้าไปจากภายนอก และเพื่อป้องกันการเกิดไวรัสที่กลายพันธุ์จนดื้อต่อ mAb ที่ใช้ฉีด ดังนั้นควรใช้ mAb มากกว่า 1 ชนิดในการฉีด
ทั้งนี้ องค์การอาหารและยา (FDA) สหรัฐอเมริกา อนุมัติการใช้ mAb แล้วหลายชนิด ทั้งแบบผสมและแบบเดี่ยว ได้แก่ Casirivimab/imdevimab ของบริษัท Regeneron, Bamlanivimab/etesevimab ของบริษัท Eli Lily, Bebtelovimab ของบริษัท Eli Lily, Sotrovimab ของบริษัท GSK และ Evusheld ของบริษัท AstraZeneca ซึ่งนอกจากจะใช้เป็นยารักษาโรคโควิด-19 แล้ว mAb ยังถือเป็นจิกซอว์ชิ้นสำคัญที่ช่วยปิดช่องว่างสำหรับคนที่ไม่สามารถฉีดวัคซีนได้หรือฉีดแล้วไม่กระตุ้นให้เกิดภูมิคุ้มกัน mAb จึงเป็นปัจจัยสำคัญส่วนหนึ่งที่จะช่วยหยุดยั้งการระบาดของโรคโควิด-19 ได้
วัคซีนพ่นจมูกแบบ 2-in-1 ใช้งานสะดวก ป้องกันได้ 2 โรค

ดร.อนันต์ จงแก้ววัฒนา ผู้อำนวยการกลุ่มวิจัยนวัตกรรมสุขภาพสัตว์และการจัดการ ไบโอเทค สวทช. และผู้เชี่ยวด้านไวรัสวิทยาแถวหน้าของประเทศไทย ได้เปิดเผยถึงงานวิจัยการพัฒนาแพลตฟอร์มที่สามารถประยุกต์ใช้ไวรัลเวกเตอร์ (Viral Vector) ที่เหมาะสมในการผลิตวัคซีนต่อโรคโควิด-19 และการออกแบบวัคซีนที่ชื่อ นาสแว็ก (NASTVAC) โดยอาศัยการนำข้อมูลเกี่ยวกับพันธุกรรมของไวรัส SARS-CoV-2 มาสร้างสารพันธุกรรมเฉพาะที่ใช้สร้างส่วนโปรตีนหนาม (Spike) จากนั้นจึงนำไปใส่ไว้กับสารพันธุกรรมของไวรัสอื่นที่ไม่เป็นอันตราย เช่น อะดีโนไวรัส (Adenovirus)
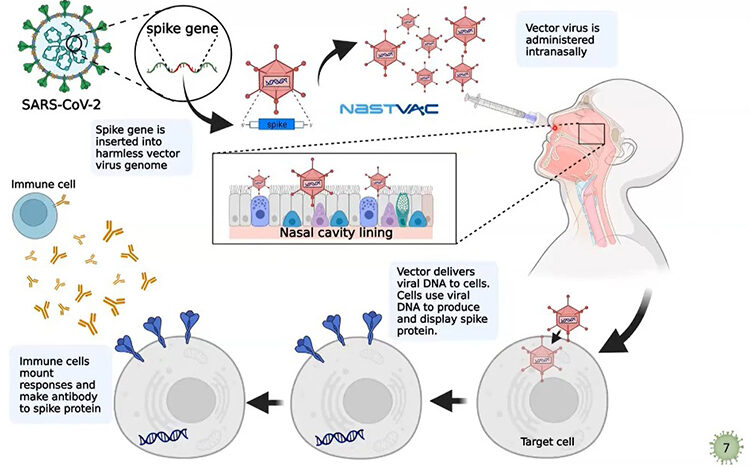
วัคซีนที่ออกแบบนี้ใช้การฉีดพ่นทางจมูกได้ เพราะไวรัสที่เลือกมาใช้เป็นไวรัลเวกเตอร์ สามารถเกาะกับเซลล์เป้าหมายในทางเดินหายใจได้ดี จึงใช้งานได้สะดวกกว่าวัคซีนชนิดฉีด และการทดลองในหนูแสดงให้เห็นว่าวัคซีนสามารถป้องกันหนูไม่ให้ป่วยจากโรคโควิด-19 ที่เกิดจากไวรัสสายพันธุ์อู่ฮั่นได้ดี โดยไปยับยั้งการเพิ่มจำนวนของไวรัสในเซลล์ของหนูทดลอง และวัคซีนไปกระตุ้นระบบภูมิคุ้มกันทั้ง 2 แบบ ทั้ง Humoral Immune Response และ Cell-Mediated Immune Response
เมื่อทดลองโดยใช้ไวรัสสายพันธุ์เดลตา พบว่าสามารถป้องกันหนูไม่ให้ป่วยได้ดีในระดับหนึ่ง แต่การปรากฏตัวของสายพันธุ์โอมิครอน ทำให้ต้องปรับโครงสร้างวัคซีน NASTVAC เวอร์ชัน 2 และ 3 ที่จะใช้ป้องกันสายพันธุ์ดังกล่าวได้ดีขึ้นตามไปด้วย แต่ยังคงใช้ไวรัลเวกเตอร์ชนิดอะดีโนไวรัสเช่นเดิม
นอกจากนี้ยังได้พัฒนาวัคซีนแบบพ่นจมูกชนิด 2-in-1 (Bivalent Vaccine) ที่ป้องกันได้ทั้งไวรัสไข้หวัดใหญ่และ SARS-CoV-2 โดยในกรณีของไวรัสไข้หวัดใหญ่ จะใช้การสร้างโปรตีนเลียนแบบโปรตีน HA ที่อยู่บนผิวของไวรัส ข้อดีของวัคซีน 2-in-1 คือสามารถป้องกันได้ทั้ง 2 โรคพร้อมกัน แพลตฟอร์มที่ใช้ทำให้สามารถปรับสร้างโปรตีนที่ต่างจากเดิมเล็กน้อยได้รวดเร็ว และกระตุ้นระบบภูมิคุ้มกันทั้ง 2 แบบ แต่ความท้าทายคือยังเป็นเทคโนโลยีที่ค่อนข้างใหม่และการหาวิธีทำให้สารพันธุกรรมเสถียรในไวรัลเวกเตอร์ยังเป็นเรื่องยาก อย่างไรก็ตาม จากการวิจัยร่วมกับทีมวิจัยของ Pasteur Institute โดยทดลองในแฮมสเตอร์ แสดงให้เห็นว่าไวรัสโรคหัดน่าจะนำมาใช้เป็น “ไวรัลเวกเตอร์” ได้ดีกับกรณีวัคซีนต่อโควิด-19 เช่นกัน
การแลกเปลี่ยนองค์ความรู้ มุมมอง ความคิด และประสบการณ์ระหว่างนานาประเทศจะเป็นอีกหนึ่งกลไกสำคัญที่ช่วยเร่งการพัฒนางานวิจัยให้เข้าถึงเส้นชัยได้เร็วยิ่งขึ้น และองค์ความรู้ที่เราพัฒนาขึ้นนี้จะช่วยให้เรามีความพร้อมรับมือกับโรคอุบัติใหม่ในอนาคตได้อย่างมีประสิทธิภาพ รวมถึงส่งเสริมให้เกิดการพัฒนาอุตสาหกรรมการแพทย์ในประเทศ และสร้างความมั่นคงทางด้านสุขภาพให้แก่ประชาชนตามแผนยุทธศาสตร์การขับเคลื่อนการพัฒนาประเทศไทยด้วยโมเดลเศรษฐกิจ BCG
สามารถชมคลิปวิดีโอการสัมมนาหัวข้อ International Webinar on COVID-19 ย้อนหลังได้ที่ https://www.nstda.or.th/nac/2022/seminar/international-webinar-on-covid-19/













